Astherna is een bedrijf dat nieuwe behandelingen ontwikkelt voor erfelijke netvliesaandoeningen, met RNA-therapie. Met deze therapie richten we ons op het stoppen van de progressie van deze aandoeningen, om zo te voorkomen dat patiënten blind worden. We richten ons als eerste op de ziekte van Stargardt. Astherna is gevestigd in Nijmegen (Nederland) en heeft een nauwe band met het Radboud Universitair Medisch Centrum. Astherna is opgericht door Rob Collin, een wetenschapper met expertise in genetische subtypes van netvliesaandoeningen en uitvinder van de RNA-therapie, samen met Carel Hoyng, een oogarts met meer dan drie decennia aan kennis van de klinische aspecten van erfelijke netvliesaandoeningen.
De eerste netvliesaandoening waarvoor Astherna een klinisch onderzoek wil naar RNA-therapie wil starten is de ziekte van Stargardt.
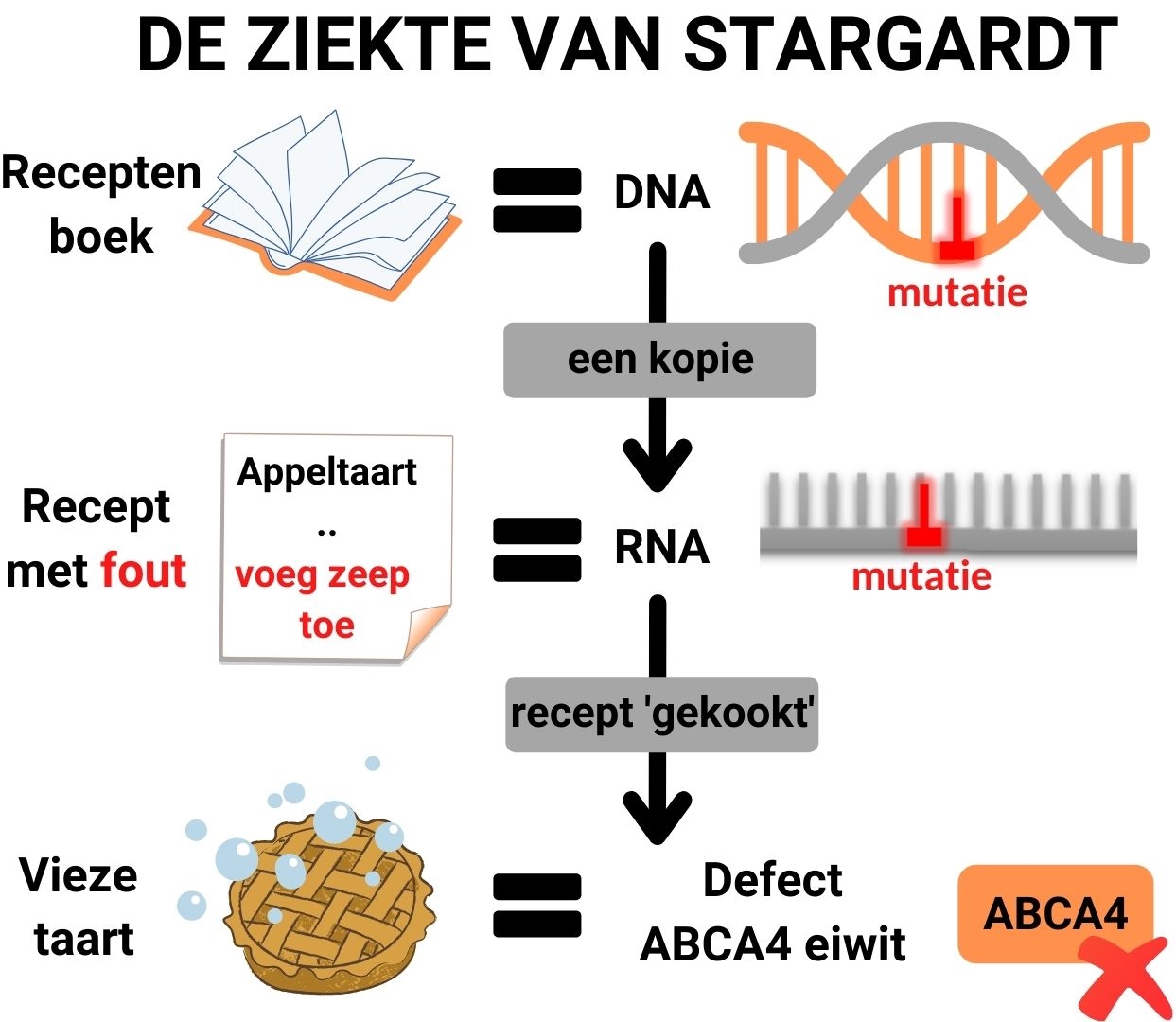
In het proces van eiwitproductie in een cel kan DNA worden gezien als het receptenboek voor eiwitten. Wanneer een eiwit gemaakt moet worden, wordt er een kopie gemaakt van het bijbehorende recept, welke instructies bevat voor de eiwitkeuken van een cel, over hoe het eiwit gemaakt moet worden. Dit kopietje van het recept heet RNA.
RNA-therapie bestaat uit een vloeistof met kleine moleculaire pleisters (AONs), die precies passen op het gebied rondom de fout (mutatie) in het ABCA4-RNA. Wanneer zo’n pleister aan het RNA bindt, bedekt het de fout in het recept, waardoor de eiwitkeuken de fout negeert en een normaal, functioneel ABCA4 eiwit produceert.
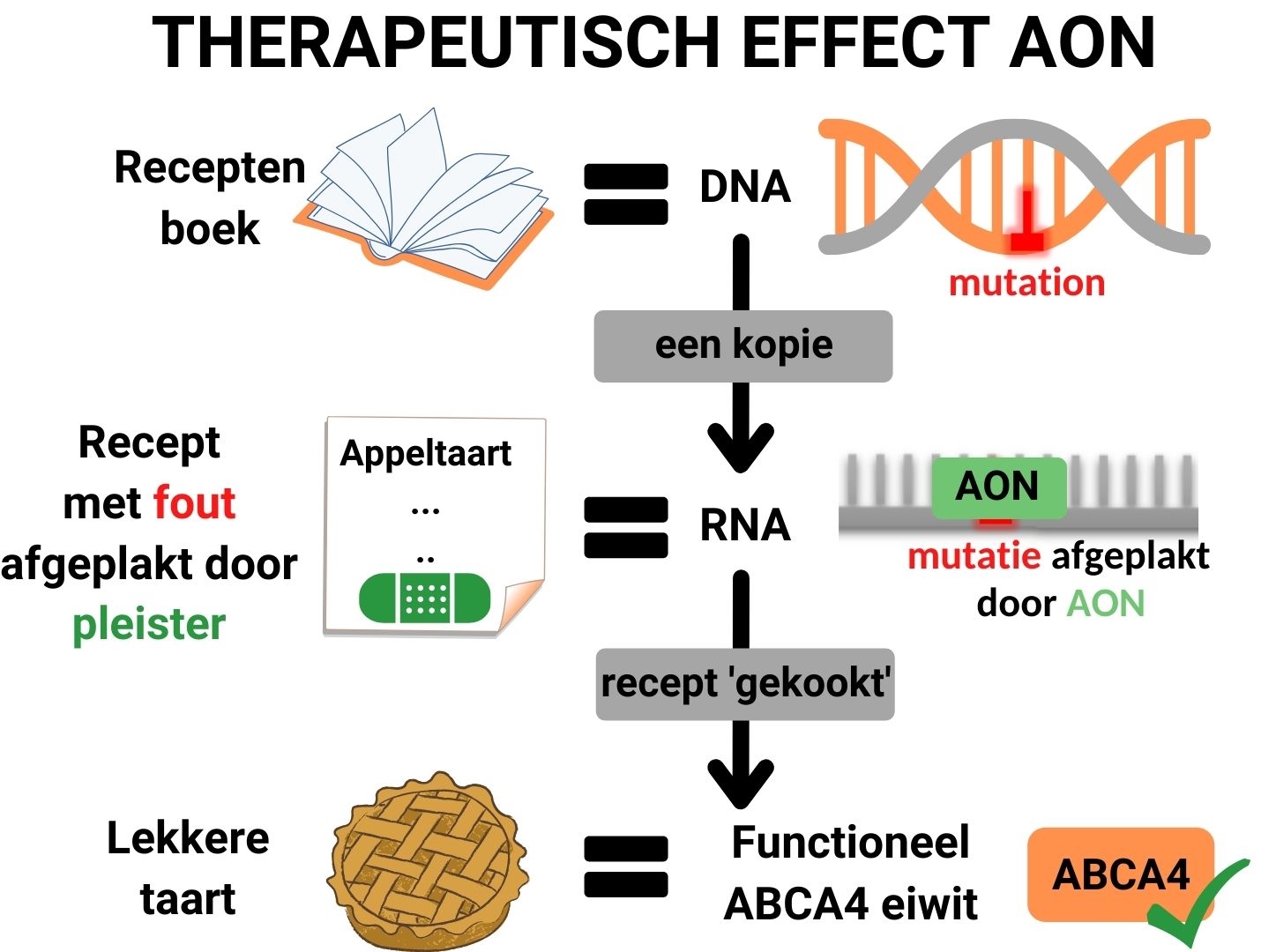
Meer gedetailleerde informatie over het werkingsmechanisme van RNA-therapie vindt u hier.
De ziekte van Stargardt wordt veroorzaakt door fouten (mutaties) in het DNA van een patiënt, die ook in het RNA voorkomen. Deze mutaties leiden tot problematische veranderingen in essentiële processen die in het oog plaatsvinden, wat resulteert in verlies van het gezichtsvermogen. Kort gezegd: RNA-therapie bestaat uit kleine moleculen, die netvliescellen binnendringen en genetische fouten in het RNA van de patiënt kunnen corrigeren.
Meer gedetailleerde informatie over de ziekte van Stargardt vind u hier.
RNA therapie werkt op een mutatiespecifieke manier, en is dus ontworpen om ziekteprogressie te stoppen door de ziekte bij de wortel van het probleem aan te pakken: fouten in het ABCA4 gen. Ieder individu heeft twee exemplaren van het ABCA4 gen: één van de moeder, en één van de vader. Patiënten met STGD1 hebben mutaties in beide exemplaren van ABCA4. Deze twee mutaties zijn vaak verschillend van elkaar, en niet elke patiënt heeft dezelfde twee mutaties in ABCA4. Er zijn zelfs meer dan 1000 verschillende mutaties bekend voor ABCA4. De ene mutatie komt vaker voor dan de andere, en de ene mutatie veroorzaakt ook meer ernstige problemen dan de andere.
Als gevolg hiervan heeft elke ABCA4-mutatie zijn eigen RNA-therapie nodig. De eerste RNA-therapie die Astherna ontwikkelt, herstelt een mutatie die vooral in Europa relatief veel voorkomt. Dit betekent echter nog steeds dat deze RNA-therapie slechts een subgroep van STGD1-patiënten kan behandelen. Wanneer deze RNA-therapie effectief is gebleken, zal Astherna doorgaan met het ontwikkelen van nieuwe RNA-therapieën voor andere mutaties, alsook voor andere netvliesaandoeningen.
Bovendien is de RNA-therapie van Astherna erop gericht om de progressie van de ziekte te stoppen. Het is onwaarschijnlijk dat het schade die al aan het netvlies is ontstaan, zal terugdraaien, maar het is wel waarschijnlijk dat het de verdere achteruitgang van het gezichtsvermogen zal voorkomen. Daarom wordt verwacht dat het meeste voordeel kan worden bereikt bij patiënten die nog resterende visuele functie hebben.
Vanwege het relatief hoge voorkomen en de ernstige aard van de ziekte van Stargardt, proberen veel wetenschappers en bedrijven over de hele wereld een behandeling te ontwikkelen met verschillende benaderingen (genbewerking, celtherapie, farmacologisch). Helaas is er tot op heden nog geen goedgekeurde behandeling beschikbaar.
De RNA-therapie zal worden toegediend via een injectie in het oog. Afhankelijk van de stabiliteit van het medicijn wordt momenteel verwacht dat er 2 tot 4 keer per jaar een nieuwe dosis moet worden gegeven.
Het ontwikkelingsproces van geneesmiddelen – van het ontdekken van een geneesmiddel in het lab, tot het voorschrijven van het geneesmiddel aan patiënten door een arts – is een lang proces. Gedurende dit proces wordt de werkzaamheid en veiligheid van het geneesmiddel gemaximaliseerd. Ook wordt het middel grondig getest, voordat het door instanties wordt toegestaan voor gebruik door patiënten. De behandeling kan echter wel al worden gegeven aan een groep STGD1-patiënten in de testfase van geneesmiddelontwikkeling. Het is dan nog onzeker of het middel werkt. De verwachting is dat de eerste onderzoeken ergens in de komende 2 jaar van start gaan.
Momenteel bevindt de RNA-therapie van Astherna zich in de preklinische fase. Dit betekent dat de effectiviteit en veiligheid van het middel worden gemaximaliseerd en getest, op basis van laboratoriumexperimenten.
Wanneer in het laboratorium is aangetoond dat een behandeling effectief en veilig is, is de volgende stap het testen van het medicijn bij patiënten, om de omvang van een mogelijk therapeutisch effect, de beste dosis en het risico op bijwerkingen te bepalen. Dit is de klinische fase, die verder kan worden onderverdeeld in drie fasen:
- Fase I: Veiligheid. Er wordt bepaald of een medicijn veilig is en of het ongewenste bijwerkingen heeft.
- Fase II: De juiste dosis. De beste dosis wordt bepaald, die zowel effectief als veilig is. Hiervoor krijgen groepen patiënten een andere dosis van het medicijn en worden deze met elkaar vergeleken.
- Fase III: Bevestiging van effectiviteit en veiligheid. Er wordt een eis gesteld aan de mate van werkzaamheid waaraan het geneesmiddel moet voldoen om door de regelgevende instanties te mogen worden geregistreerd. In een fase III-studie worden patiënten die met het medicijn worden behandeld vergeleken met patiënten die een ‘nepbehandeling’ (placebo) krijgen, om conclusies te trekken over of aan de veiligheids- en werkzaamheidseisen wordt voldaan.
- Nadat een medicijn toegelaten is tot de geneesmiddelenmarkt, worden er aanvullende fase IV studies uitgevoerd om lange termijn veiligheid en effectiviteit te monitoren.


